Микобактериозы – группа инфекционных заболеваний человека и животных, включая все виды птиц, вызываемая бактериями рода Mycobacterium.
Большинство видов микобактерий
птиц вызывают хроническую (зачастую без проявления внешней симптоматики в течение длительного периода времени) полиорганную инфекцию с поражением печени, селезенки, легких, кишечника, суставной и костной ткани.
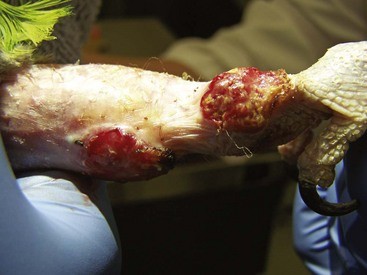
Также процесс может протекать локально, с поражением отдельных участков кожи и прилежащих тканей (чаще в области головы либо конечностей).
Некоторые виды возбудителя являются зооантропонозными, т.е.заразны для животных и человека. К ним относятся в том числе Mycobacterium tuberculosis, M.bovis и M.avium, вызывающие у людей туберкулёз. Передача возбудителя может происходить от птицы человеку и наоборот – в равной степени и люди, болеющие туберкулёзом, несут опасность заражения для домашних птиц, проживающих с ними.
Помимо трех вышеобозначенных видов, есть и другие микобактерии (M.fortuitum, M. scrofulaceum, M. intracellulare и др.), встречающиеся у птиц и потенциально опасные для людей. Чаще они не вызывают системных поражений (тубёркулеза), однако могут провоцировать очаговые хронические дерматиты с образованием абсцессов; главным образом, к группе риска по подобным атипичным микобактериозам относятся дети младшего возраста, пожилые люди, ВИЧ-положительные, онко-больные, а также люди, проходящие химиотерапию или иммуносупрессивную терапию.
Проблема постановки диагноза на микобактериоз и лабораторной диагностики данного заболевания у птиц стоит весьма остро, и на то есть несколько причин:
1. неравномерное выделение возбудителя из организма больного животного – не каждая проба помета может нести в себе микобактерии или содержать достаточное их количество для диагностики. Отсюда вытекает две сопутствующие проблемы:
1.1 необходимость проведения серий анализов – окраска по Цилю-Нильсену, ПЦР, посевы на питательные среды– для постановки окончательного диагноза;
1.2 зачастую требуется концентрация микобактерий в материале (методом флотации) перед проведением анализа, что в разы повышает эффективность обнаружения возбудителя при любом методе диагностики (окраске, ПЦР, посевах).

Микроскопия окрашенной по методу Циля-Нильсена мокроты человека, больного туберкулезом: справа на фото материал после концентрации (источник: статья «Методы окраски микроорганизмов» probakterii.ru)
2. необходимость концентрации материала приводит к последующей сложности: соответствующее оснащение лабораторий для безопасной работы с концентрированным зооантропонозным возбудителем в материале для проведения анализов. Именно за счёт повышенного риска для сотрудников при работе с концентрированными пробами единицы лабораторий (как правило, это государственные лаборатории на базе НИИ) ведут данную деятельность.
Выдержка из статьи «Туберкулез – профессиональное заболевание у медицинских работников» В.В.Косарев, С.А.Бабанов: «По степени риска заражения туберкулезом медицинские работники распределяются следующим образом: на первом месте — персонал бактериологических лабораторий (контакт с больными туберкулезом и живой патогенной культурой); затем — работники стационаров противотуберкулезных учреждений (контакт с больными с лекарственной устойчивостью микобактерий, что подтверждает внутрибольничный путь заражения); … распространенность латентной туберкулезной инфекции крайне высока среди медицинских работников (31,3 %), в особенности среди сотрудников противотуберкулезной службы (49,3 %)…»
[немаловажно: риск заражения владельца прямо пропорционален длительности его проживания с зараженной птицей, т.к.птица-бактериовыделитель способствует поддержанию высокой, нарастающей концентрации микобактерий в помещении, особенно при отсутствии регулярной уборки со специфическими дез.средствами, т.к.микобактерии являются кислото-, спирто-, щёлоче-устойчивыми микроорганизмами, длительно сохраняющимися в окружающей среде]
Для диагностики микобактериозов у содержащихся в неволе птиц в России доступны следующие методы:
Окраска по методу Циля-Нильсена:
Материал: помет, мокрота, мазки со слизистых оболочек и из очагов поражения кожи, синовиальная и перитонеальная жидкость, мазки-отпечатки органов при посмертной диагностике.
Принцип метода основан на обнаружении микобактерий при микроскопии материала – в готовом мазке они окрашены в красный цвет красителем фуксином Циля, т.к.являются кислотоустойчивыми, большинство же других микроорганизмов обесцвечивается (на этапе промывания мазка серной кислотой после фуксина) и затем окрашивается в синий (на этапе завершающей окраски метиленовой синью).
| Преимущества: | Недостатки: |
|
|

Окрашенные по методу Циля-Нильсена помёт жако – слева (более 40 микобактерий в поле зрения микроскопа), помёт сизого голубя – по центру (единичные микобактерии в поле зрения), помёт кореллы – справа (более 100 микобактерий в поле зрения). Фото автора.
При последующей сдаче помёта от данных пациентов на ПЦР-диагностику только от жако с первого же раза была получена положительная ПЦР и подтвержден возбудитель M.bovis. Две другие птицы прореагировали ложно-отрицательно. Корелла прореагировала положительно при повторной ПЦР по помёту. Голубь прореагировал ложно-отрицательно при повторной ПЦР по помёту, но диагноз был подтвержден по ПЦР крови.
ПЦР (полимеразная цепная реакция):
Материал: кровь, помет, мокрота, мазки со слизистых оболочек и из очагов поражения кожи, синовиальная и перитонеальная жидкость, кусочки органов при посмертной диагностике.
| Преимущества: | Недостатки: |
|
|
Посевы на питательные среды:

Материал: помет, мокрота, мазки со слизистых оболочек и из очагов поражения кожи, синовиальная и перитонеальная жидкость, кусочки органов при посмертной диагностике.
Метод основан на культивировании (высевании) бактерий из материала на специальных питательных средах (наиболее часто используемой является среда Левенштейна-Йенсена), с целью обнаружения роста возбудителя и дальнейшего получения чистой культуры микобактерий для проведения последующей типизации.
| Преимущества: | Недостатки: |
|
|
Туберкулинизация (аллерго-диагностика):
Метод основан на выявлении местной аллергической реакции на введение птице внутрикожно туберкулина (готовится из очищенной убитой культуры микобактерий) – положительная реакция обуславливается специфическим иммунным ответом со стороны организма, т.е.свидетельствует об активном взаимодействии возбудителя микобактерий с организмом птицы.
| Преимущества: | Недостатки: |
|
|
Таким образом, выборочное использование только одного из представленных выше методов для постановки или опровержения окончательного диагноза на микобактериоз у птиц не является объективным.
Необходимо также учитывать, что даже единоразовое получение от обследуемого животного любого положительного результата при любом методе диагностики, является прямым показанием к рассмотрению птицы как подозрительной по микобактериозу, т.е.требующей системного разностороннего подхода к лабораторной диагностике и отбора серии проб в первую очередь для исключения опасности зоонатропонозной инфекции для владельца.
Автор: ветеринарный врач Мария Маркина.
заглавное фото: фрагмент картины Louis Edouard Dubufe
